PERDARAHAN SALURAN CERNA BAGIAN ATAS
A. Definisi
Perdarahan SCBA adalah hilangnya darah dari saluran cerna atas yang secara anatomis terletak di atas ligamentum Treitz, yaitu esofagus, gaster hingga duodenum bagian horizontal (PGI, 2012; Taylor dkk, 2014). Ada pun manifestasi klinis yang timbul dari perdarahan SCBA adalah hematemesis, keluarnya darah atau pun bekuan darah dari nasogastric tube, dan/atau melena, serta dapat pula berupa hematoskezia bila terjadi perdarahan SCBA yang massif dan cepat (PGI, 2012; ASGE, 2012).
B. Epidemiologi
Sebagian besar perdarahan saluran cerna disebabkan
oleh perdarahan SCBA, yaitu sekitar 65-80% (Zuckerman, 2000). Perdarahan SCBA
disebutkan sebagai salah satu kegawatdaruratan di bidang gastroenterologi dan
menjadi penyebab kunjungan tersering di ruang gawat darurat (Taylor dkk, 2014).
Angka kejadian perdarahan SCBA selama beberapa dekade terakhir ini tidak
mengalami perubahan, meskipun telah ada kemajuan dalam hal pengelolaan dan
terapi perdarahan SCBA. Hal ini diperkirakan sangat berkaitan dengan penggunaan
aspirin dan obat-obatan anti inflamasi nonsteroid yang semakin sering digunakan
pada praktek klinik sehari-hari (Maduseno, 2011; Robinson dkk, 2012).
Insiden perdarahan SCBA berbeda-beda di setiap
negara. Di Belanda insiden perdarahan SCBA adalah sebesar 37 per 100 ribu populasi
dewasa (Jansen dkk, 2011; Schiefer dkk, 2012), di Denmark sekitar 48 ribu per
100 ribu populasi dewasa (Yavorski dkk, 1995), di Amerika dan di Inggris adalah
sebesar 150-172 per 100 ribu populasi dewasa (Leerdam dkk, 2003). Data mengenai
insiden perdarahan SCBA pada populasi yang sebenarnya di Indonesia masih belum
diketahui secara pasti, namun diperkirakan sekitar 46-150 per 100 ribu populasi
dewasa (PGI, 2012). Sebagian besar perdarahan SCBA dapat berhenti dengan
sendirinya, dan hanya sekitar 10% yang memerlukan tindakan khusus berupa
endoskopi terapeutik atau pun pembedahan (Augustin dkk, 2010; Biecker, 2013).
Meskipun hanya 10% kasus yang memerlukan penatalaksanaan khusus, namun biaya
kesehatan yang diperlukan untuk penatalaksanaan kasus tersebut dan
penatalaksanaan komplikasi terkait kasus tersebut masih tetap tinggi. Adapun
biaya kesehatan yang dibutuhkan untuk penatalaksanaan kasus ini adalah sebesar
3402-5632 US dollar (Cremers dan Ribeiro, 2014).
Komplikasi yang dapat timbul terkait perdarahan SCBA adalah kematian dan perdarahan ulang (Ramaekers dkk, 2016). Angka kematian terkait perdarahan SCBA hingga saat ini masih cukup tinggi, yaitu 10-20%, namun hal ini sudah jauh lebih baik dibandingkan sebelum tahun 1995, yaitu sebesar 33-50%. Kejadian perdarahan ulang pada perdarahan SCBA adalah sebesar 5-15% (Leerdam, 2008; El-Tawil, 2012). Berdasarkan penelitian Robinson dkk (2012), komplikasi kematian terkait perdarahan SCBA adalah sebesar 23-35%, sedangkan komplikasi berupa perdarahan ulang dan kematian pada perdarahan SCBA didapatkan nilai yang jauh lebih tinggi, yaitu sekitar 60-65%.
C. Etiologi
Umumnya perdarahan SCBA dapat dikelompokkan menjadi 2 penyebab, yaitu perdarahan variseal dan non variseal. Perdarahan variseal merupakan perdarahan yang timbul akibat pecahnya varises esofagus, gaster dan hypertensive portal gastropathy sebagai akibat hipertensi portal (Taylor dkk, 2014). Sekitar 60- 65% dari perdarahan SCBA pada sirosis hati disebabkan oleh perdarahan variseal. Ada pun dua pertiga (sekitar 65%) dari perdarahan variseal disebabkan oleh pecahnya varises esofagus, sedangkan hypertensive portal gastropathy sebesar 15% dan pecahnya varises gaster hanya berkisar 5-10% (Berzigotti dkk, 2001; Tsao dkk, 2007; Biecker, 2013). Perdarahan non variseal merupakan perdarahan SCBA yang bukan disebabkan oleh pecahnya varises esofagus, gaster maupun hypertensive portal gastropathy. Penyebab-penyebab perdarahan SCBA adalah ulkus peptikum, gastritis erosif, robekan Mallory-Weis, keganasan pada SCBA, esofagitis, dan malformasi vaskuler (BSG, 2002). Penyebab perdarahan SCBA di negara-negara Barat sebagian besar disebabkan oleh perdarahan non variseal, yaitu ulkus peptikum. Ada pun insiden ulkus peptikum sebagai penyebab perdarahan SCBA adalah sebesar 63% (Tielleman dkk, 2015). Penyebab perdarahan SCBA di Indonesia umumnya lebih banyak disebabkan oleh perdarahan variseal, yaitu sekitar 50-60% dari seluruh kasus perdarahan SCBA (Djumhana, 2011; PGI, 2012).
Terdapat beberapa faktor risiko yang turut berperan dalam pathogenesis perdarahan SCBA. Faktor risiko perdarahan SCBA akibat perdarahan variseal lebih berkaitan dengan tingginya tekanan vena portal yang terjadi, hal ini seiring dengan beratnya derajat sirosis hati dan besar ukuran varises (Tsao dkk, 2007; Waleleng dkk, 2015). Gangguan fungsi ginjal dan infeksi disebutkan dapat menjadi pencetus untuk terjadinya perburukan dari hipertensi portal yang telah ada (Tsao dkk, 2007; Crooks, 2013). Faktor risiko yang berkaitan dengan perdarahan non variseal adalah infeksi Helicobacter pylori, obat-obatan anti inflamasi nonsteroid, obat anti agregasi platelet, dan usia lanjut (PGI, 2012; Tielleman dkk, 2015). Selain faktorfaktor tersebut, beberapa penelitian menyebutkan pula bahwa konsumsi alkohol berlebih; merokok; dan penyakit-penyakit komorbid seperti gangguan ginjal, penyakit jantung koroner, dan diabetes mellitus meningkatkan risiko timbulnya perdarahan non variseal (Crooks, 2013).
D. Patogenesis Perdarahan SCBA
1. Perdarahan
Variseal
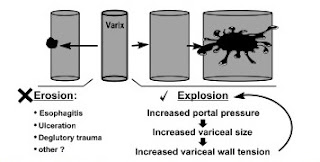
Umumnya terdapat 2 teori yang menjelaskan tentang
timbulnya perdarahan SCBA akibat perdarahan variseal, yaitu teori erosi dan
teori eksplosif. Pada teori erosi disebutkan bahwa perdarahan variseal timbul
sebagai akibat trauma eksternal yang menyebabkan erosi pada pembuluh darah
varises yang berdinding tipis dan rapuh. Faktor trauma eksternal yang menjadi
penyebab perdarahan variseal adalah adanya esofagitis dan makanan solid yang
dapat mengakibatkan iritasi dan erosi pada dinding pembuluh darah varises.
Teori eksplosif menyebutkan bahwa perdarahan variseal lebih disebabkan oleh
perburukkan hipertensi portal yang telah ada sehingga meningkatkan tekanan
hidrostatik pada pembuluh darah yang mengalami varises. Hal tersebut
mengakibatkan peningkatan ukuran varises dan menurunnya ketebalan dinding pembuluh
darah sehingga daya regang pembuluh darah pun menurun (Berzigotti dkk, 2001).
Penelitian-penelitian yang ada telah mendukung teori
eksplosif untuk menjelaskan perdarahan variseal. Semakin tinggi gradient
tekanan portal maka akan memberikan risiko yang lebih tinggi pula untuk
terjadinya perdarahan variseal dan dapat mempersulit dalam penatalaksanaan
perdarahan yang terjadi. Sebagian besar perdarahan variseal akan timbul bila
gradien tekanan portal >12mmHg. Sebaliknya bila gradien tekanan portal dapat
diturunkan menjadi 20% dari gradien tekanan portal awal dapat menurunkan risiko
terjadinya perdarahan ulang (Berzigotti dkk, 2001; Waleleng dkk, 2015)
2. Perdarahan Non
Variseal
Lumen gaster memiliki pH yang asam. Kondisi ini
berkontribusi dalam proses pencernaan tetapi juga berpotensi merusak mukosa
gaster. Beberapa mekanisme telah terlibat untuk melindungi mukosa gaster. Musin
yang disekresi sel-sel foveola gastrica membentuk suatu lapisan tipis yang
mencegah partikel makanan besar menempel secara langsung pada lapisan epitel.
Lapisan mukosa juga mendasari pembentukan lapisan musin stabil pada permukaan
epitel yang melindungi mukosa dari paparan langsung asam lambung, selain itu
memiliki pH netral sebagai hasil sekresi ion bikarbonat sel-sel epitel
permukaan. Suplai vaskular ke mukosa gaster selain mengantarkan oksigen,
bikarbonat, dan nutrisi juga berfungsi untuk mengencerkan asam yang berdifusi
ke lamina propia. Gastritis akut atau kronik dapat terjadi dengan adanya
gangguan pada mekanisme-mekanisme protektif tersebut (Turner, 2010)
Pembentukan musin pada usia lanjut akan mengalami
penurunan, sehingga lebih rentan terkena gastritis dan perdarahan saluran cerna
(Turner, 2010). Obat anti inflamasi nonsteroid dan obat anti agregasi platelet
dapat mempengaruhi proteksi sel (sitoproteksi) yang umumnya dibentuk oleh
prostaglandin atau mengurangi sekresi bikarbonat yang menyebabkan meningkatnya
perlukaan mukosa gaster (Soll dan Graham, 2015). Infeksi Helicobacter pylori
yang predominan di antrum akan meningkatkan sekresi asam lambung, peningkatan
keasaman pada duodenum, dan kerusakan mukosa hingga terjadi ulkus duodenum.
Sekresi gastrin akan meningkat, baik pada sekresi basal mau pun sekresi yang
dirangsang oleh makanan, sedangkan sekresi somatostatin oleh sel D akan menurun.
Peningkatan asam lambung dapat pula timbul akibat efek sitokin-sitokin
proinflamasi, seperti interleukin-1 (IL-1), IL-8 dan tumor necrosis factor
(TNF), pada sel-sel parietal, sel G, dan sel D (Valle, 2013).
Perlukaan sel secara langsung juga dapat disebabkan konsumsi alkohol yang berlebih. Alkohol merangsang sekresi asam lambung sehingga menyebabkan perlukaan mukosa saluran cerna (Soll dan Graham, 2015). Pada terapi radiasi dan kemoterapi menyebabkan kerusakan mukosa menyeluruh karena hilangnya kemampuan regenerasi sel (Turner, 2010).
E. Manifestasi Klinis Perdarahan SCBA
Manifestasi klinis perdarahan SCBA, baik pada
perdarahan variseal dan non variseal, umumnya berupa hematemesis dan/atau
melena. Hematemesis merupakan muntah darah yang berwarna merah atau kehitaman.
Muntah darah berwarna kehitaman disebabkan oleh konversi hemoglobin menjadi
hematin akibat adanya paparan asam lambung terhadap darah (Laine, 2005). Melena
menggambarkan feses berwarna hitam yang mengandung darah akibat proses
pencernaan. Feses biasanya berwarna hitam seperti ter, berbau busuk, dan
lengket (Bogoch, 1985; Laine, 2005).
Perubahan
warna feses menjadi hitam sangat dipengaruhi oleh lokasi perdarahan, jumlah dan
laju perdarahan, serta kecepatan transit di usus. Terkait dengan kecepatan
transit di usus maka melena menginformasikan bahwa darah telah berada dalam
saluran cerna selama minimal 14 jam. Selain berwarna hitam sebagai melena,
perdarahan SCBA dapat pula bermanifestasi sebagai hematoskezia, yaitu feses
yang berwarna merah segar karena mengandung darah. Hematoskezia umumnya
merupakan manifestasi klinis perdarahan saluran cerna bagian bawah, namun jika
perdarahan SCBA disertai dengan hematoskezia maka menandakan bahwa telah
terjadi perdarahan SCBA yang masif (Laine, 2005).
Pada perdarahan SCBA akibat perdarahan variseal umumnya akan dijumpai pula tanda-tanda sirosis hati/penyakit hati kronik berupa ginekomastia, spider nevi, splenomegali, ascites, eritema palmaris, dan/tanpa ensefalopati hepatik (Djumhana dkk, 1998; Laney dan Greene, 2015; Rockey dkk, 2016). Gejala lain yang dapat dijumpai pada perdarahan SCBA non variseal adalah rasa pusing, kepala terasa ringan dan lemas. Keluhan berupa lemas, pusing dan kepala terasa ringan timbul akibat anemia yang telah terjadi (Simon dkk, 2015).
F. Diagnosis Perdarahan SCBA
Anamnesis dan pemeriksaan fisik merupakan bagian
dari pendekatan diagnosis pada perdarahan SCBA. Tujuan dari tindakan tersebut
adalah untuk mencari manifestasi klinis, faktor risiko, komorbiditas, dan
penilaian berat-ringannya perdarahan yang terjadi, serta memperkirakan penyebab
perdarahan SCBA, yaitu variseal ataukah non variseal (Adi, 2014).
Berat-ringannya perdarahan SCBA, berdasarkan atas anamnesis dan pemeriksaan
fisik, dapat disesuaikan dengan klasifikasi hipovolemia akibat perdarahan
(Basket, 1990).
Pemasangan nasogastric tube merupakan tindakan medis
yang dapat membantu untuk mengkonfirmasi adanya perdarahan SCBA. Selain itu
beberapa manfaat dari pemasangan nasogastric tube adalah memperkirakan jumlah
perdarahan, mempersiapkan lapang pandang yang bersih untuk tindakan endoskopi,
mencegah aspirasi isi lambung ke jalan nafas, dan mengurangi beban amoniak
pencetus ensefalopati hepatik pada perdarahan variseal dengan sirosis hati. Ada
pun komplikasi yang dapat timbul akibat pemasangan nasogastric tube adalah
epistaksis dan erosi pada gaster (Chalasani dkk, 1997; Sarin dkk, 2011).
Pemeriksaan laboratorium merupakan pemeriksaan
penunjang yang dapat digunakan untuk membantu menilai berat-ringannya
perdarahan SCBA. Pemeriksaan laboratorium tersebut antara lain adalah
pemeriksaan darah lengkap, creatinine serum, blood urea nitrogen, enzim
transaminase hati, faal hemostasis, dan asam laktat (Taylor dkk, 2014; Simon
dkk, 2015; Laney dan Greene, 2015).
Pemeriksaan endoskopi merupakan pemeriksaan pilihan
utama pada perdarahan SCBA. Pemeriksaan ini disebutkan sebagai baku emas untuk
penegakan diagnosis perdarahan SCBA, namun ada pun keunggulan dari pemeriksaan
ini adalah dapat memberikan visualisasi secara langsung lokasi dan penyebab
perdarahan serta aktivitas dari perdarahan tersebut. Selain itu, endoskopi
dapat pula menjadi terapi intervensi pilihan dalam penatalaksanaan perdarahan
SCBA. Ada pun waktu yang disarankan untuk melakukan pemeriksaan tersebut adalah
dalam 24 jam setelah didapatkan adanya manifestasi perdarahan SCBA, sedangkan
pada kondisi terjadi instabilitas hemodinamik akibat perdarahan masif maka
pemeriksaan tersebut sebaiknya dilakukan segera setelah resusitasi (Sung dkk,
2011; NICE, 2012; ASGE, 2012; Gralnek dkk, 2015).
Temuan endoskopi pada perdarahan SCBA, khususnya perdarahan non variseal, dapat diklasifikasikan dengan kriteria Forrest. Kriteria tersebut dapat digunakan untuk menilai risiko perdarahan ulang pada perdarahan SCBA. Selain itu, penggunaan klasifikasi tersebut dapat menjadi petunjuk pilihan terapi yang diperlukan untuk penatalaksanaan perdarahan SCBA (PGI, 2012; Laine dan Jensen, 2012).
G. Penatalaksanaan Perdarahan SCBA
Tujuan utama pengelolaan perdarahan SCBA adalah
stabilisasi hemodinamik, menghentikan perdarahan, mencegah perdarahan ulang dan
menurunkan mortalitas.
1. Penatalaksanaan
Umum
Pada kondisi hemodinamik tidak stabil atau kondisi
syok, maka resusitasi cairan, baik cairan kristaloid atau pun koloid, harus
segera diberikan. Cairan kristaloid dengan akses perifer dapat diberikan pada
perdarahan ringan sampai sedang. Pada kondisi perdarahan berat, cairan koloid
dapat digunakan setelah pemberian cairan kristaloid sebanyak 1500-2000 ml
terlebih dahulu, sembari menunggu ketersediaan transfusi darah (Purnomo, 2010;
Adi, 2016). Pemasangan kateter vena sentral diperlukan pada keadaan syok yang
memerlukan pemantauan ketat dari cairan yang diberikan. Selain itu kateter vena
sentral diperlukan pula pada pasien usia lanjut dengan kondisi syok, pasien
dengan gagal ginjal kronik dan pasien dengan penyakit jantung, sehingga
resusitasi cairan dapat diberikan secara optimal (Cappel, 2008; Albeldawi,
2010). Target resusitasi adalah hemodinamik stabil, produksi urin cukup (>30
ml/jam), tekanan vena sentral 5-10 cmH2O, kadar Hb tercapai, yaitu 8 gr/dL pada
perdarahan variseal dan 7-9 gr/dL pada perdarahan non variseal (Purnomo, 2010;
Nusi dan Vidyani, 2016). Pemberian oksigen diperlukan terutama pada pasien usia
lanjut dan pasien dengan penyakit jantung. Pada pasien yang menggunakan
antikoagulan maka penggunaan antikoagulan tersebut harus dihentikan dan perlu
dilakukan terapi terhadap koagulopati yang terjadi. Pada pasien yang
menggunakan antikoagulan dan terdapat koagulopati dengan international
normalized ratio (INR) >1,5 memiliki risiko yang lebih besar untuk mengalami
perdarahan ulang (Albeldawi, 2010).
2. Penatalaksanaan
Perdarahan Variseal
-
Terapi
Farmakokinetik
·
Vasokonstriktor
splanknik
· Vasopresin
(analog)
· Somatostatin
(analog)
· Beta
Blocker non-caardioselective
Farmakoterapi
dengan somatostatin (analog) efektif dalam menghentikan perdarahan, setidaknya
untuk sementara, pada hingga 80% pasien. Somatostatin mungkin lebih unggul
daripada octreotide analognya. Sekitar 30% pasien tidak merespon β-blocker
dengan penurunan gradien tekanan vena hati (HVPG), meskipun dengan dosis yang
memadai. Non-responder ini hanya dapat dideteksi dengan pengukuran HVPG
invasif. Selain itu, β-blocker dapat menyebabkan efek samping seperti kelelahan
dan impotensi, yang dapat mengganggu kepatuhan (terutama pada pria yang lebih
muda), atau β-blocker dapat dikontraindikasikan karena alasan lain.
·
Vasokonstriktor
dan vasodilator
Terapi
kombinasi mengarah pada efek sinergis dalam mengurangi tekanan portal. Menggabungkan
isosorbide 5-mononitrate dengan β-blocker nonselektif telah terbukti memiliki
efek aditif dalam menurunkan tekanan portal dan sangat efektif pada pasien yang
tidak merespon terapi awal dengan β-blocker saja. Namun, efek menguntungkan ini
mungkin sebanding dengan efek merugikan pada fungsi ginjal dan kematian jangka
panjang, terutama pada mereka yang berusia di atas 50 tahun. Oleh karena itu,
penggunaan terapi kombinasi secara rutin tidak dianjurkan ((Brecque, Khan, Sarin and Le Mair, 2014)).
-
Terapi endoskopi
·
Terapi local
·
Ligasi varises
endoskopi (EVL) atau skleroterapi
Skleroterapi
endoskopi dan ligasi pita varises efektif dalam menghentikan perdarahan hingga
90% pasien. EVL lebih efektif daripada endoskopi varises skleroterapi (EVS)
dengan kontrol perdarahan yang lebih besar, perdarahan ulang yang lebih rendah,
dan efek samping yang lebih rendah tetapi tanpa perbedaan dalam mortalitas.7, 8
Namun, ligasi pita endoskopi mungkin lebih sulit diterapkan daripada
skleroterapi pada perdarahan aktif.
·
Terapi Shunting
·
Pembedahan atau
radiologis (Transjugular Intrahepatic Portosystemic Shunt, TIPS)
Transjugular intrahepatik portosystemic shunt (TIPS) adalah alternatif yang baik ketika pengobatan endoskopi dan farmakoterapi gagal.
·
Mengurangi
tekanan portal
Penggunaan
tamponade balon menurun, karena ada risiko tinggi perdarahan ulang setelah
deflasi dan risiko komplikasi besar. Namun demikian, tamponade balon efektif
dalam banyak kasus untuk menghentikan perdarahan setidaknya untuk sementara,
dan dapat digunakan di wilayah yang mana EGD dan TIPS tidak tersedia. Ini dapat
membantu menstabilkan pasien untuk mendapatkan waktu dan akses ke EGD dan /
atau TIPS nanti.
- Gabungan pengobatan endoskopi dan farmakologis terbukti mencapai kontrol perdarahan akut yang lebih baik daripada pengobatan endoskopi saja (Word Gastrology Organisation, 2013).
|
Metode |
Meknisme |
Keuntungan |
Kekurangan |
Visualisasi |
|
Endoscopic variceal ligation |
·
Obliterasi lengkap
varises esofagus (OV) |
·
Mudah
digunakan ·
Lebih
unggul dari skleroterapi |
·
Memerlukan
sesi endoskopi berulang ·
Risiko
pasca-banding ulkus dan pembentukan striktur |
|
|
Endoscopic glue injection |
·
Solidifikasi varises
lambung |
Tingkat hemostasis inisial yang tinggi |
Komplikasi langka yaitu emboli paru, trombosis vena limpa dan
portal and |
|
|
Endoskopik injeksi lem dengan panduan ultrasonik ±
melingkar |
·
Penilaian
sonografi dari aliran darah dengan Doppler |
·
Memungkinkan
visualisasi selama perdarahan masif ·
Tingkat
perdarahan ulang rendah ·
Meminimalkan
jumlah lem dan risiko emboli lem ·
Meminimalkan
jumlah sesi endoskopi |
·
Komplikasi
langka yaitu ekstrusi lem dan emboli paru ·
Tergantung
kemampuan |
|
|
Hemostatic powder(TC325, Hemospray) |
·
Non-absorbable
mineral powders ·
Barrier
penghalang mekanis dengan air |
· Kemampuan hemostatik awal yang
tinggi · Mudah digunakan · Peran potensial dalam tumor
berdarah atau lesi difus |
· Tingkat perdarahan ulang yang
tinggi, durasi terapi yang pendek · Harus diikuti dengan endoskopi
second-look atau modalitas hemostatik kedua · Komplikasi yang jarang terjadi
adala perforasi lambung dan obstruksi bilier |
|
|
Fully covered self-expandable metal
stent |
Kontrol sementara dari perdarahan varises refrakter |
· Tingkat keberhasilan klinis lebih
tinggi dari balon tamponade · Menurunkan risiko robekan
esofagus, iskemia mukosa, dan pneumonia aspirasi |
·
Persediaan
terbatas ·
Tergantung
kemampuan |
|
3.
Penatalaksanaan
Perdarahan Non Variseal
Pendekatan multidisipliner, dengan melibatkan
spesialis penyakit dalam/gastroenterologist, radiologist intervensional, dan
ahli bedah/bedah digestif. Stratifikasi pasien ke dalam kategori risiko rendah
atau tinggi untuk kejadian pendarahan ulang dan mortalitas dapat digunakan
dengan skor Blatchford dan Rockall. Pemasangan nasogastric tube (NGT)
dilakukan pada perdarahan yang diduga masih berlangsung disertai dengan
gangguan hemodinamik. Resusitasi yang dilakukan termasuk pemberian cairan
intravena dan suplementasi oksigen, koreksi koagulopati berat dan transfusi
darah pada saat dibutuhkan. Pemberian PPI sebelum endoskopi dapat digunakan
untuk pasien dengan PUP. Suasana lingkungan asam menyebabkan penghambatan
agregasi trombosit dan koagulasi plasma, juga menyebabkan terjadinya lisis pada
bekuan yang telahnterbentuk.
-
PPI dalam bentuk bolus maupun drip, jika tidak ada bisa
diberikan antagonis H2 reseptor
-
Sitoprotektor : Sukralfat 3-4 x 1 gram atau Teprenon 3 x1
tab atau Rebamipide 3x100mg
-
Injeksi vit K 3x1 ampul, untuk pasien dengan penyakit
hati kronis atau sirosis hati
Kadar hemoglobin minimal untuk dilakukan endoskopi adalah 8 mg/dL dan jika akan dilaksanakan endoskopi terapeutik maka kadar hemoglobin minimal adalah 10 mg/dL dengan catatan pasien juga dalam keadaan hemodinamik stabil. Terdapat beberapa terapi endoskopi yang dapat menjadi pilihan dalam penatalaksanaan perdarahan non variseal, yaitu penyuntikan adrenaline yang telah diencerkan, termokoagulasi, dan hemoclip. Tindakan endoskopi ini sebaiknya dilakukan dalam 24 jam setelah didapatkan adanya manifestasi klinis perdarahan SCBA dengan Forrest I dan Forrest IIA (Sung dkk, 2011; PGI, 2012; ASGE, 2012; Gralnek dkk, 2015).
Selain itu ada beberapa metode endoskopi yang sering digunakan dalam terapi nonvariceal yang akan dijelaskan dalam tabel di bawah ini (Lau and Sung, 2020) :
|
Metode |
Meknisme |
Keuntungan |
Kekurangan |
Visualisasi |
|
Over-the-scope clip (OTSC) |
·
Mechanical hemostasis ·
Klip kaliber besar terbuat dari
logam nitinol dengan shape-memory effect
|
·
Tingkat
keberhasilan klinis yang tinggi ·
Dapat
digunakan sebagai terapi pada perdarahan refrakter |
Komplikasi berat jarang terjadi, obstruksi usus, mikroperforasi,
dan deviasi posisi |
|
|
Diluted epinephrine |
·
Vasoconstriction ·
Efek
tamponade |
Kontrol sementara perdarahan untuk membantu visualisasi |
Tingkat perdarahan ulang yang tinggi jika digunakan sebagai
monoterapi |
|
|
Thermal coagulation |
·
Menghasilkan
energi panas atau arus listrik ·
Koaptasi
pembuluh darah |
Hemostasis definitif |
·
Resiko
perforasi ·
Pendarahan
tertunda karena cedera termal |
|
|
Through-the-scope clip(TTSC) |
·
Mechanical hemostasis |
· Desain baru klip yang dapat
diputar dan dibuka kembali · Cedera termal minimal (lebih baik
dalam kasus koagulopati) |
Sulit untuk mengakses ulkus fibrotic dengan akses endoskopi
terbatas |
|
|
Hemostatic powder(TC325, Hemospray) |
·
Non-absorbable
mineral powders ·
Barrier
penghalang mekanis dengan air |
· Kemampuan hemostatik awal yang
tinggi · Mudah digunakan · Peran potensial dalam tumor
berdarah atau lesi difus |
· Tingkat perdarahan ulang yang
tinggi, durasi terapi yang pendek · Harus diikuti dengan endoskopi
second-look atau modalitas hemostatik kedua · Komplikasi yang jarang terjadi
adala perforasi lambung dan obstruksi bilier |
|
|
Endoscopic suturing device (Apollo
Overstitch) |
Melindungi ulkus peptic dari lingkungan asam intragastrik |
Pilihan terapi pada perdarahan refrakter |
·
Persediaan
terbatas ·
Tergantung
kemampuan |
|
Tatalaksana
eradikasi H. pylori
• Tes H. pylori direkomendasikan
pada semua pasien perdarahan ulkus peptikum à jika (+), diberikan terapi tripel selama 1 minggu
• Setelah pemberian
terapi eradikasi, pemeriksaan
konfirmasi harus dilakukan menggunakan urea breath test (UBT)
atau H.pylori stool
antigen test à jika
eradikasi berhasil, PPI dihentikan
• Pada pasien yang
memerlukan terapi NSAID, sebaiknya dari golongan COX-2-selective dengan
dosis efektif terendah ditambah PPI
• Pasien ulkus
idiopatik (non-H. pylori,
non-NSAID) perlu diberi PPI jangka panjang (PGI, 2012)
H. Komplikasi Perdarahan SCBA
Komplikasi perdarahan SCBA dapat timbul dalam
beberapa jam hingga beberapa hari setelah terjadi perdarahan, bahkan dapat pula
timbul setelah beberapa minggu setelah terjadinya perdarahan SCBA. Berdasarkan
Ferguson dan Mitchell (2005), komplikasi perdarahan SCBA dapat dibedakan
menjadi komplikasi dini dan komplikasi lambat. Komplikasi dini merupakan
komplikasi yang timbul selama perawatan di rumah sakit atau 5-7 hari setelah
terjadinya perdarahan SCBA, sedangkan komplikasi lambat adalah komplikasi yang
timbul setelah keluar rumah sakit atau 7 harisetelah terjadinya perdarahan SCBA
(Ferguson dan Mitchell, 2005; Maggio dkk, 2013).
Komplikasi perdarahan SCBA dapat berupa perdarahan ulang dan kematian. Tingkat kematian dan perdarahan ulang pada perdarahan SCBA sangat bergantung pada penyebab perdarahan, yaitu variseal atau non variseal. Pada perdarahan variseal risiko terjadi perdarahan ulang cukup tinggi, sekitar 60%, terutama pada 6 minggu pertama setelah perdarahan SCBA terjadi (Cremers dan Ribeiro, 2014). Risiko perdarahan ulang pada perdarahan non variseal dengan klasifikasi Forrest IIB, IIC dan III didapatkan lebih rendah bila dibandingkan perdarahan variseal, yaitu sekitar 5-15% (Leerdam, 2007). Kematian dapat disebabkan oleh perdarahan masif yang menimbulkan syok hipovolemik atau pun perburukan kondisi terkait penyakit-penyakit komorbiditas yang ada pada pasien, seperti penyakit ginjal kronik, penyakit jantung kongestif, dan kondisi infeksi (Cappel dkk, 2008; Sonnenberg, 2012).
I. Stratifikasi Risiko Komplikasi
Stratifikasi risiko komplikasi bertujuan untuk
mendeteksi lebih awal kelompok pasien dengan perdarahan SCBA yang akan
mengalami komplikasi, sehingga dapat dilakukan intervensi dan penatalaksanaan
yang lebih baik guna mencegah timbulnya komplikasi tersebut. Umumnya
stratifikasi risiko komplikasi menggunakan sistem berbasis skor agar mudah
untuk diaplikasikan. Menurut Stanley (2012), sistem evaluasi berbasis skor
untuk yang baik adalah mudah dihitung, akurat dan relevan untuk menilai hasil
yang diinginkan, dan dapat digunakan pada awal manifestasi klinis, dalam hal
ini sebelum dilakukan evaluasi endoskopi Saat ini telah banyak sistem
stratifikasi risiko komplikasi perdarahan SCBA yang telah dikembangkan.
Sistem-sistem stratifikasi tersebut umumnya dapat dikelompokkan menjadi 2
kelompok, yaitu sistem stratifikasi risiko yang menggunakan tindakan endoskopi
dan sistem stratifikasi risiko yang tidak menggunakan endoskopi. Ada pun sistem
stratifikasi yang telah direkomendasikan untuk mengevaluasi risiko komplikasi
perdarahan SCBA adalah sistem GBS dan Rockal score (NICE, 2011; PGI, 2012;
ASGE, 2012; Gralnek dkk, 2015).
·
Sistem Stratifikasi Risiko Komplikasi
Menggunakan Endoskopi
·
Rockall
Score
Sistem stratifikasi ini diperkenalkan oleh Rockall
dkk pada tahun 1997. Sistem skor ini terdiri atas 2 bagian, yaitu pre-endoskopi
yang dikenal dengan clinical Rockall score dan post-endoskopi atau yang dikenal
dengan full Rockal score. Sistem stratifikasi ini menyebutkan semakin tinggi
skor yang didapat, maka risiko komplikasi berupa perdarahan ulang dan kematian
pun semakin meningkat. Skor 8 (Bakhtavar dkk, 2016; Monteiro dkk, 2016).
·
Sistem
Stratifikasi Risiko Komplikasi Tanpa Endoskopi
·
GBS
(Glasgow-Blatchford Score)
GBS
pertama kali diperkenalkan oleh Blatchford dkk untuk menilai perlunya perawatan
rumah sakit untuk intervensi (transfusi darah, tindakan terapi endoskopi atau
pembedahan) dan risiko kematian pada perdarahan SCBA. Uji validasi yang
dilakukan pada tahun 2000 terhadap sistem skor ini menyebutkan bahwa nilai GBS
0 merupakan kelompok dengan risiko rendah dan dapat menjalani rawat jalan,
sedangkan semakin tinggi nilai GBS maka mengindikasikan perlunya tindakan
intervensi untuk mencegah komplikasi perdarahan SCBA (Blatchford dkk, 2000).
Skor ini telah dipergunakan secara luas untuk menilai risiko komplikasi
perdarahan SCBA akibat perdarahan non variseal dan disebutkan pula dari
beberapa penelitian bahwa skor ini memberikan hasil yang lebih baik untuk
memprediksi komplikasi yang dapat timbul pada perdarahan SCBA dibandingkan
dengan Rockall score (Pang dkk, 2010; Jeune dkk, 2011; Ahn dkk, 2013).
DAFTAR
PUSTAKA
Berzigotti, A. and Bosch, J., 2018. Diagnostic Methods for
Cirrhosis and Portal Hypertension. Cham: Springer International Publishing.
Brecque, L., Khan, A., Sarin, S. and Le Mair, A., 2014. Esophageal
varices. World Gastroenterology Organisation Global Guidelines.
Djumhana A. 2011. Perdarahan
Akut Saluran Cerna. Bandung: FK UNPAD.
Friedlander J, Mamula
P. 2011. Gastrointestinal Hemorrhage in Pediatric Gastrointestinal and Liver
Disease, IVth Ed. Philadelphia:Elsevier.
Hadi S. 2010. Perdarahan
Saluran Makan. Bandng: PT Alumni.
Laine L, Jensen DM. 2012. Management of patients with ulcer bleeding. Am J Gastroenterol.,107:345-
60
Lau, L. and Sung, J., 2020. Treatment of upper
gastrointestinal bleeding in 2020: New techniques and outcomes. Digestive
Endoscopy, [online] 33(1), pp.83-94. Available at: <https://onlinelibrary.wiley.com/doi/full/10.1111/den.13674>
[Accessed 1 June 2021].
Perhimpunan Dokter Spesialis Penyakit Dalam Indonesia. 2019. Penatalaksanaan
di Bidang Ilmu Penyakit Dalam: Panduan Praktik Klinis. Jakarta:
InernaPublishing
Perkumpulan Gastroenterologi Indonesia. 2012. Konsensus Nasional
Penatalaksanaan Perdarahan Saluran Cerna Atas non Varises di Indonesia.
Jakarta: Perkumpulan Gastroenterologi Indonesia
Ponijan AP. 2012. Perdarahan
Saluran Cerna Bagian Atas. Medan: FK USU.
Shah VH. 2010. Sleisenger
and Fordan’s Gastrointestinal and Liver Disease Pathophysiology
Diagnosi/Management 9th edition vol 2. USA: Saunder Elsevier.
Soll AH, Graham YD. 2015. Peptic ulcer disease. In: Yamada T, ed. Textbook of gastroenterology.
Turner JR. 2010. The gastrointestinal tract. In: Kumar V, Abbas A.K, Fausto N, Aster J.C. Robbins and cotran pathologis basis of disease. 8th ed. Philadelphia: Elsevier Saunders Inc; 763-70.












Comments
Post a Comment
Mari berkomentar dengan baik dan bijak.....